Wpływ pH i zasolenia na fotosyntezę u moczarki kanadyjskiej - praca badawcza z Olimpiady Biologicznej

Po dłuższej przerwie w publikacji prac badawczych przedstawiam pracę laureata minionej edycji Olimpiady Biologicznej. Pomimo iż nie jest ona wolna od pewnych niedociągnięć, myślę że stanowi dobrą ilustrację jak można podejść do tego etapu olimpiady, jak powinien wyglądać plakat (oryginał w załączeniu), a załączone recenzje mogą zwrócić uwagę uczestników na pewne aspekty tego typu prac i sposób ich oceniania. Autorowi natomiast gratuluję sukcesu :)
Zamieszczone na stronie prace służą jedynie zapoznaniu się z ogólnym charakterem prac badawczych zgłaszanych na Olimpiadę Biologiczną. Niedopuszczalne jest kopiowanie całej koncepcji wykonania pracy bądź fragmentów jej tekstu we własnej pracy. Tego typu działania będą uznawane za plagiat i mogą wiązać się z odrzuceniem pracy przez komisję olimpiady.
Wpływ pH wody i stężenia chlorku sodu na intensywność fotosyntezy moczarki kanadyjskiej (Elodea canadensis Michx.).
AUTOR: Mateusz Piętak
Streszczenie
Obiektem badań opisywanych w tej pracy badawczej jest moczarka kanadyjska (Elodea canadensis Michx). Zdobywanie wyników polegało na mierzeniu objętości gazu, jaką wydzielała moczarka po 11 godzinach prowadzenia doświadczenia, w określonych warunkach pH i stężenia chlorku sodu – które były w tym doświadczeniu zmiennymi zależnymi. Badanych było 3 zakresy pH (pH = 5, pH = 6, pH = 7) i 3 zakresy stężenia procentowego NaCl jednocześnie (0,01% ; 0,05% ; 0,25%) , co dało w rezultacie 9 różnych prób badawczych. Otrzymane i uśrednione wyniki pozwalają stwierdzić, że moczarka fotosyntetyzuje tym lepiej, im pH wody jest niższe, i tym lepiej, im stężenie chlorku jest wyższe (w badanym zakresie). Takie informacje mogą być wykorzystane przez np.: akwarystów. Dlatego, że moczarka jest rośliną często hodowaną w akwariach, znajomość jej wymagań względem badanych czynników jest dla tej grupy hobbystów cenną informacją. Dodatkowo, tę wiedzę można wykorzystać do przyjaznego środowisku usuwania moczarki z siedlisk, w których jest ona niepożądana – gdyż w pewnych warunkach może być obecnie uznawana w dalszym ciągu za gatunek inwazyjny.
Wstęp
Moczarka kanadyjska (Elodea canadensis Michx.) jest wodną byliną pochodzącą z Ameryki Północnej, a w szczególności z obszarów Kanady. Stamtąd została zawleczona m.in. do Europy, gdzie dzięki swojej dużej ekspansywności, szybko uzyskała status rośliny inwazyjnej (Dajdok i Pawlaczyk, 2009). Świadczy o tym potoczna nazwa jaką zyskała ta roślina w początkowym etapie swojej inwazji – „zaraza wodna”. Z uwagi na tworzenie długich pędów i tworzenia zwartych fitocenoz w wielu zbiornikach wodnych powodowała duże utrudnienia w żegludze i rybołówstwie, np.: przez owijanie się wokół śrub napędowych łodzi. Obecnie straty gospodarcze powodowane przez moczarkę kanadyjską nie są tak duże jak jeszcze w XIX w., niemniej jednak wciąż uznawana jest za gatunek inwazyjny m.in. ze względu na zagrożenie jakim jest dla wielu ekosystemów wodnych. Np.: Typ siedliska nr 3260 (Nizinne i podgórskie rzeki ze zbiorowiskami włosieniczników Ranunculion fluitantis) często pada ofiarą ekspansji moczarki kanadyjskiej, przez co rodzime gatunki tego siedliska zostają wyparte.
W badaniu starałem się poznać zakres tolerancji ekologicznej moczarki kanadyjskiej względem zasolenia wody oraz wartości jej pH, co mogłoby pomóc lepiej zrozumieć funkcjonowanie tej rośliny, a to ewentualnie ułatwiłoby eliminowanie jej z siedlisk gdzie jest niepożądana lub wręcz przeciwnie – ułatwiłoby jej hodowlę w zbiornikach takich jak np.: oczka wodne lub nawet akwaria.
Materiały i metody
1) Badane moczarki kanadyjskie (Elodea canadensis Michx.) pozyskałem ze sklepu akwarystycznego w Biłgoraju. Są to rośliny wodne należące do rodziny żabiściekowatych, z rodzaju moczarka. Przy dobieraniu osobników skupiłem się na tym, aby wybrać roślinki o najbujniejszym ulistnieniu, tak aby wyniki prób były porównywalne, a ilość wytwarzanego gazu – odpowiednio duża. Wykonałem w sumie 40 powtórzeń doświadczenia, z czego:
- 4 dotyczyło próby kontrolnej,
- 36 dotyczyło prób badawczych.
Wszystkie badania prowadziłem w domu. Badane przeze mnie czynniki wpływające na tempo fotosyntezy to pH wody oraz stężenie chlorku sodu (symbolizujące ogólne zasolenie wody) w wodzie. Jak widać na tabeli załączonej obok, zdecydowałem się na badanie 3 zakresów pH (zdecydowałem się na wybór zakresu pH 5-7 ze względu na występujące w obecnych czasach kwaśne deszcze, które mogą się przyczyniać do zakwaszania naturalnych zbiorników wodnych, więc moja praca pomogłaby mi zrozumieć, jak to zjawisko wpływa na badany gatunek) oraz 3 zakresów stężenia NaCl (stężenia soli niewielkie, możliwie występujące w naturalnych i sztucznych zbiornikach, chociażby ze względu na wykorzystywanie soli do odśnieżania dróg w okresie zimowym, oraz w akwariach). Krzyżując ze sobą wszystkie te czynniki, otrzymałem 9 różnych możliwych warunków do przeprowadzania prób badawczych, co pomnożone przez 4 próby na każdy jeden warunek pH i Cp% NaCl (większa liczba prób zapewniła większą wartość statystyczną otrzymanych wyników), dało wspomniane wcześniej 36 powtórzeń doświadczenia.
2) Przygotowanie próby badawczej polegało między innymi na otrzymaniu odpowiedniego pH wody, oraz obliczeniu odpowiedniej ilości soli niezbędnej do otrzymania pożądanego jej stężenia – i dokładnym odważeniu odpowiedniej wagi soli kuchennej (o 98% zawartości NaCl, pozostały skład jonowy nie uwzględniany ze względu na znikomy wpływ na fizjologię rośliny). Pierwszym etapem było uzyskanie mieszanki wody wodociągowej z wodą gazowaną. Zdecydowałem się na zrobienie tego w stosunku objętościowym 3:2, tak, aby dzięki wodzie gazowanej zapewnić roślinom odpowiednie stężenie jonów HCO3- i aby niedostępność tych jonów nie była czynnikiem ograniczającym zachodzenia fotosyntezy roślin w moim doświadczeniu. 500 ml takiej mieszanki (300 ml wody wociągowej o temperaturze 20°C oraz 200 ml wody gazowanej firmy Muszynianka [średnionasycona CO2; stężenie jonów wodorowęglanowych ~2000 mg/l]) wlewałem do słoika o pojemności 900 ml. Następnie, do cylindra miarowego o podziałce pozwalającej na odmierzenie 250 ml cieczy, wprowadziłem taką samą mieszankę (150 ml wody wodociągowej, 100 ml wody gazowanej). Sumarycznie więc, każda z prób badawczych to 750 ml wody. Mając to na uwadze, obliczałem odpowiednie wartości wagi soli kuchennej jaką muszę wprowadzić, aby otrzymać pożądane stężenie, a następnie rozpuszczałem dokładnie odważoną (fotografia 1; na wadze laboratoryjnej zakupionej w sklepie Internetowym, o dokładności pomiaru +/- [0,01 g]) ilość soli w wodzie w słoiku o objętości 900 ml (zawsze korzystałem z dwóch identycznych słoików).

Z powodu długiego czasu przeprowadzania próby, zdecydowałem że użycie wody destylowanej jako środowiska doświadczenia będzie złym pomysłem, gdyż może się okazać, że będzie miała ona negatywny wpływ na fizjologię rośliny. Ustaliłem więc, że mając na uwadze to, że każda mieszanina wodna jest przygotowywana w taki sam sposób, jej skład jonowy pomijałem w obliczeniach, a stężenie NaCl wody opierałem jedynie na dodawanej przez siebie ilości soli... Tak otrzymany roztwór badałem pH-metrem (zakupionym przez Internet; dokładność pomiaru: +/- [0,1]) i w zależności od wyniku pomiaru pH (pomiar przedstawiony na fotografii nr 2) i od przygotowywanej próby dodawałem kwasku cytrynowego zakupionego w sklepie spożywczym (w celu obniżenia pH roztworu) bądź też etyloaminy (w celu podwyższenia pH roztworu; etyloaminę pozyskałem z pracowni chemicznej mojej szkoły) w ostrożny sposób – tak, aby otrzymać pożądaną wartość pH roztworu (np. aby otrzymywać roztwór o pH = 6 musiałem dodawać niewielką ilość kwasku cytrynowego do mieszaniny wyjściowej).

W taki sam sposób postępowałem z wodą w cylindrze miarowym (pozyskanym również z pracowni LO im. ONZ w Biłgoraju). Po takim przygotowaniu zestawu, pobierałem z mojego 110-litrowego akwarium jedną z wielu moczarek tak, by miała ona około 30 cm długości. Przy doborze osobników dużą wagę przywiązywałem do wybierania zawsze moczarek podobnych do siebie – tj. o praktycznie identycznym stopniu ulistenienia, wielkości i liczby liści – tak, aby wyniki prób były miarodajne. Moczarkę wprowadzałem do cylindra miarowego, cylinder zatykałem szczelnie woreczkiem foliowym i gumką recepturką, odwracałem go do góry dnem, wprowadzałem do słoika, a następnie łyżeczką delikatnie ściągałem woreczek z wlotu cylindra. Następnie zawieszałem cylinder lekko nad dnem słoika (sposób przygotowania próby ukazany na fotografii nr 3), ustawiałem w odległości około 15 cm od lampki o mocy żarówki 40 W, odczytywałem objętość gazu obecną w cylindrze na podstawie jego podziałki, a następnie włączałem lampkę i zostawiałem tak przygotowaną próbę na okres 11 godzin. Po tym czasie odczytywałem objętość gazu w cylindrze i porównywałem ją z wartością początkową. Im większa była ta różnica – oznaczało to, że tym więcej moczarka wydzieliła tlenu w wyniku procesu fotosyntezy, co skutkowało większym wyparciem słupa wody z cylindra. Przez cały czas trwania doświadczenia, zestawy badawcze nie były narażone na zewnętrzne oświetlenie, a w pokoju panowała stabilna temperatura. Ilość wykonanych doświadczeń to 36.

3) Zestawy próby kontrolnej były przygotowane w identyczny sposób jak te z próby badawczej, z tą różnicą, że nie ingerowałem w skład jonowy wody (nie dodawałem NaCl, pozostały jedynie jony obecne w wyjściowej mieszaninie) i wyrównałem poziom pH do neutralnego (pH=7). Sposób odczytywania wyników i wszelkie parametry nie różniły się od tych z próby badawczej. Wykonałem ich w sumie 4, każda w taki sam sposób.
Wyniki
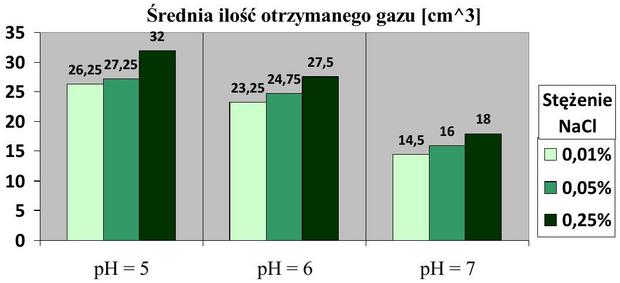
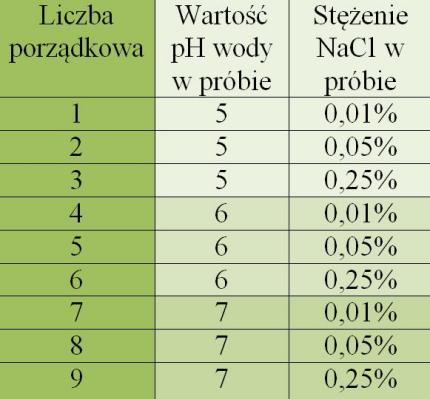
Wynikiem każdej z prób była objętość gazu wytworzona przez moczarkę po 11 godzinach prowadzenia doświadczenia. Otrzymane rezultaty uśredniłem (4 próby na każde warunki przeprowadzania doświadczenia, czyli 9 różnych zakresów pH i stężenia NaCl, co przedstawione jest w podrozdziale „Materiały i metody” w tabeli 1) i przedstawiłem je w formie graficznej na powyższym wykresie. Widoczna jest tendencja malejąca w tempie zachodzenia fotosyntezy u moczarki kanadyjskiej przy wzroście pH środowiska (przy każdym badanym stężeniu chlorku sodu) – oznacza to, że roślina fotosyntetyzowała intensywniej (wydzielała więcej gazu) w warunkach o pH wody niższym, niż w warunkach o pH wody wyższym. Rosnące stężenie chlorku sodu natomiast (przy każdym badanym pH wody) w badanym zakresie wpływało na wzrost intensywności zachodzenia fotosyntezy moczarki kanadyjskiej. Przedstawione wyniki to wartość uśredniona, więc dołączam poniżej tabelę prezentującą wartość odchyleń standardowych dla każdej ze średnich. Wszystkie wartości odchylenia, z wyjątkiem jednej, nie przekraczają wartości 1,9, co oznacza, że otrzymywane w doświadczeniu wyniki były powtarzalne i miarodajne.
Dyskusja
Moczarka kanadyjska to roślina wodna o bardzo dużej ekspansywności. Szeroki zakres tolerancji ekologicznej względem wielu czynników środowiska umożliwił jej w wielu krajach XIX-wiecznej Europy uzyskać status gatunku inwazyjnego (Wielka Encyklopedia Przyrody, 1998). Tworzenie zwartych skupisk i występowanie w ogromnych ilościach powodowało duże straty w żeglarstwie, oraz utrudnienia w infrastrukturze wodnej. Obecnie inwazyjność moczarki kanadyjskiej w stosunku do tej sprzed dwóch wieków jest mniejsza. Tłumaczy się to między innymi mniejszą dostępnością form zredukowanych żelaza w wodach w których bytują moczarki (są to mikroelementy o dużym znaczeniu dla wzrostu tych roślin [Bowmer, Jacobs i Sainty 2009]), oraz ociepleniem klimatu (Kolada i Kutyła, 2016) (mimo, że moczarki kanadyjskie mają szeroki zakres tolerancji względem temperatury wody, to preferują one wody raczej chłodniejsze). To, że liczebność moczarki kanadyjskiej w Europie w ostatnich dziesięcioleciach zaczęła maleć (Polakowska, 1976), nie oznacza jednak, że jest ona całkowicie nieszkodliwa. Jak wspomniane było we wstępie tej pracy, może ona pozostawać niebezpieczna dla niektórych naturalnych siedlisk występujących na terenie Polski lub w wypadku jej nadmiernego rozrostu w np.: zbiorniku sztucznym służącym do celów infrastrukturalnych / rekreacyjnych, może stanowić poważne utrudnienie w funkcjonowaniu takiej struktury.
Hodując osobiście moczarkę kanadyjską w akwarium wiem, że ma ona duże walory estetyczne. Stąd też w celu prowadzenia mojego doświadczenia – oprócz poznania warunków, w których moczarka rozwija się gorzej, starałem się też pozyskać informację o warunkach, w których moczarka kanadyjska będzie rozwijała się lepiej. Uzyskane wyniki pozwalają jednoznacznie stwierdzić, że w badanym zakresie pH (5-7), Elodea canadensis fotosyntetyzuje tym intensywniej, im pH wody jest niższe. Ilość otrzymywanego w wyniku fotosyntezy w cylindrze miarowym tlenu w warunkach pH = 5 była przy każdym stężeniu procentowym NaCl stosunkowo wyższa, niż ilość ta przy warunkach pH = 7. Skoro więc roślina w takich warunkach wydziela więcej gazu (a gazem tym na pewno jest tlen), to intensywniej fotosyntetyzuje – a skoro intensywniej fotosyntetyzuje, można się spodziewać, że na dłuższą metę, jej rozwój byłby również lepszy, a roślina wzrastałaby szybko. Wynikają z tego następujące wnioski.
Z punktu widzenia akwarystów hodujących tą roślinę, aby spodziewać się jej dobrej kondycji, należałoby zadbać o odpowiednio niskie pH wody w akwarium. Nie można oczywiście zapominać o innych organizmach akwarium, takich jak inne rośliny wodne, czy też ryby, które mogą być znacznie bardziej wrażliwe na zmianę pH wody niż moczarka. W tym wypadku należy więc zachować rozsądek w dobieraniu warunków prowadzenia akwarium i dobrać tzw. „złoty środek” jeśli chodzi o pH – nie zbyt kwaśny dla innych organizmów w akwarium.
Inny punkt widzenia należy rozpatrzyć w wypadku założenia sytuacji, gdzie moczarka jest organizmem niepożądanym, np.: w śluzie wodnej. Jest to budowla hydrotechniczna, której funkcjonalność zależy w dużej mierze od łatwości przepływu wody, więc gęste skupiska roślin (a takie tworzy moczarka), na pewno będą przeszkadzać w jej działaniu. W takim wypadku, wnioskując na podstawie otrzymanych wyników, można by było podnieść pH wody przepływającej przez śluzę wodną. Zakładając, że jest to struktura, gdzie biocenoza nie odgrywa znaczącej roli (podniesienie pH mogłoby się okazać katastrofalne w skutkach dla miejscowej biocenozy), byłoby to rozwiązanie stosunkowo korzystne, gdyż inne środki walki z moczarką prawdopodobnie byłyby bardziej czasochłonne i kosztowne.
Wzrastające stężenie NaCl w badanym zakresie, podobnie jak pH wody, wpływało na wzrost intensywności moczarki kanadyjskiej. Przy określonym pH, im wyższe było stężenie chlorku sodu, tym więcej gazu otrzymywałem w próbie. Oznacza to, że moczarka kanadyjska wymaga odpowiednio wysokiego stężenia kationów sodu i anionów chlorkowych do najbardziej optymalnego rozwoju. W przeciwieństwie do wartości pH, regulowanie stężenia NaCl w badanym zakresie można wykorzystać raczej tylko do poprawy warunków jej hodowli. Dla akwarystów jest to cenna informacja – na podstawie wyników doświadczenia widać, że należy zadbać o odpowiednie stężenie tych jonów (Na+ i Cl-), aby spodziewać się odpowiedniego wzrostu moczarek. W przypadku ograniczenia wzrostu moczarek z powodu stężeń tych jonów wodzie w badanym zakresie, należałoby prowadzić do ich bardzo niskich stężeń, co w dużych zbiornikach wodnych, np.: chociażby w stawie, jest procesem praktycznie niemożliwym. Dodatkowo, kationy sodu i jony chlorkowe są niezbędne do funkcjonowania wszystkich organizmów wodnych, więc ich bardzo niskie stężenia w akwenie oznaczają nie tylko ograniczenie rozwoju moczarki, ale i też wszelkich innych form życia. Wiedzy tej więc nie można wykorzystać do zwalczania moczarki kanadyjskiej jako gatunku inwazyjnego w środowisku.
Otrzymane wyniki i wysunięte wnioski nie określają całego zakresu tolerancji ekologicznej moczarki kanadyjskiej na pH wody i stężenia NaCl, ale wyznaczają jedynie fragment niszy ekologicznej tego gatunku. Oznacza to, że dalsze badania prowadzone pod tym kątem, mogą dostarczyć nowych, ciekawych informacji, które mogą wnieść dużo wartościowych wskazówek do branży akwarystycznej, wodno-ogrodniczej (np. oczka wodne) oraz do zarządzania sztucznymi zbiornikami wodnymi.
Piśmiennictwo
- Bowmer K., Jacobs S.W.L., Sainty G.R.: Identification, Biology and Management of Elodea canadensis , Hydrocharitaceae (ang.). W: J. Aquat.
- Zygmunt Dajdok i Paweł Pawlaczyk ; „Inwazyjne gatunki roślin ekosystemów mokradłowych Polski” ; 2009, Wydawnictwo Klubu Przyrodników
- Agnieszka Kolada, Sebastian Kutyła. Elodea canadensis (Michx.) in Polish lakes: a non-aggressive addition to native flora. „Biological Invasions”, 2016
- Maria Polakowska: Rośliny wodne. Warszawa: Wydawnictwa Szkolne i Pedagogiczne, 1976, s. 86
- Rośliny kwiatowe. Warszawa: Muza S.A., 1998, s. 346, seria: Wielka Encyklopedia Przyrody.
- Strona internetowa poświęcona moczarce kanadyjskiej w ujęciu akwarystycznym, (dostęp 29.12.2016)
- Zaloguj się albo zarejestruj aby dodać komentarz
