Wpływ wybranych czynników na fermentację alkoholową - praca badawcza z Olimpiady Biologicznej

Oto kolejna tegoroczna praca badawcza. Również i ona została zakwalifikowana do wyróżnienia przez KOOB zyskując 49 pkt. Uwagę zwraca precyzyjne i logiczne zaplanowanie badań oraz ich dokładny opis, dzięki czemu pomimo wybrania dość znanego i przebadanego problemu praca znalazła uznanie w oczach recenzenta. Gratuluję autorowi pracy i mam nadzieję, że lektura jego dzieła będzie inspirująca dla kolejnych olimpijczyków.
Zamieszczone na stronie prace służą tylko zapoznaniu się z ogólnym charakterem prac badawczych zgłaszanych na OB. Niedopuszczalne jest kopiowanie całej koncepcji wykonania bądź fragmentów jej tekstu we własnej pracy. Tego typu działania będą uznawane za plagiat i mogą wiązać się z odrzuceniem pracy przez komisję OB.
Zależność intensywności procesu fermentacji alkoholowej od temperatury otoczenia, odczynu pH oraz stężenia substratu na przykładzie drożdży piekarniczych (Saccharomyces cerevisiae)
AUTOR: Konrad Majewski
Streszczenie
Przedmiotem moich badań było określenie wpływu, jaki na intensywność procesu fermentacji alkoholowej wywierać mogą trzy czynniki środowiskowe: temperatura otoczenia, stężenie substratu niezbędnego do przebiegu reakcji oraz odczyn pH roztworu. Jako organizm modelowy wykorzystałem liofilizowane drożdże piekarnicze (Saccharomyces cerevisiae). Po przeprowadzeniu serii eksperymentów doszedłem do wniosku, iż każdy z wymienionych czynników wywiera istotny wpływ na badany proces, zaś charakter owego wpływu w znacznym stopniu zależy od natężenia danego czynnika w środowisku. Ostatecznie stwierdziłem, że w przypadku drożdży piekarniczych, fermentacja zachodzi najintensywniej w temperaturze 45°C, przy 6%-owym stężeniu substratu oraz pH pożywki zbliżonym do 5.
Wstęp
Aby rosnąć i prawidłowo funkcjonować, każdy organizm musi korzystać z energii zawartej w cząsteczkach związków organicznych, które powstały podczas fotosyntezy bądź chemosyntezy lub zostały pobrane z zewnątrz. Głównym procesem metabolicznym, który umożliwia pozyskanie owej energii, jest oddychanie komórkowe, mogące mieć charakter tlenowy bądź beztlenowy1. Drożdże piekarnicze są organizmami zdolnymi do przeprowadzania jednego z typów oddychania beztlenowego - fermentacji alkoholowej, jednakże w obecności tlenu mogą prowadzić dużo bardziej efektywne oddychanie tlenowe. Zawierają one komplet enzymów łańcucha glikolizy oraz zasadnicze enzymy dla fermentacji alkoholowej2. W czasie fermentacji, otrzymany podczas glikolizy pirogronian zostaje przekształcony w aldehyd octowy, a następnie w etanol, przy czym w drugiej reakcji zachodzi niezbędna do podtrzymania glikolizy reoksydacja NADH + H+ do NAD+ 3. Ów cykl reakcji katalizują dwa enzymy - dekarboksylaza pirogronianowa oraz dehydrogenaza alkoholowa.
Materiały i metody
| Domena | Jądrowe |
| Królestwo | Grzyby |
| Gromada | Grzyby właściwe |
| Podgromada | Workowce |
| Klasa | Drożdżaki |
| Rząd | Drożdżowce |
| Rodzina | Drożdżowate |
| Rodzaj | Drożdże |
| Gatunek | Drożdże piekarnicze |
Systematyka wykorzystanego gatunku 4
Zmiany w intensywności procesu fermentacji alkoholowej obserwowałem z wykorzystaniem drożdży piekarniczych Saccharomyces cerevisiae (tabela 1.). Podczas każdego z 74 eksperymentów, przeprowadzonych w dniach 21.06.2014r. - 17.08.2014r., wykorzystywałem po 2,5 g organizmów w formie liofilizowanej ("Drożdże instant" Dr. Oetkera zakupione w sklepie spożywczym). Wybór drożdży w takiej, a nie innej formie nie był przypadkowy - wykorzystanie drożdży świeżych byłoby obciążone ryzykiem wystąpienia zmian w żywotności badanych organizmów. Aby jeszcze bardziej ujednolicić każdą z prób badawczych, mieszałem ze sobą zawartość pięciu paczek drożdży, a następnie przechowywałem je w zacienionym pomieszczeniu w temperaturze pokojowej. Odważoną z wykorzystaniem wagi laboratoryjnej o dokładności 0,01 g ilość organizmów wsypywałem do kolby stożkowej o pojemności 150 ml. Następnie, do zlewki o pojemności 250 ml wlewałem maksymalną ilość wody o temperaturze 30°C, którą kontrolowałem z wykorzystaniem termometru laboratoryjnego rtęciowego oraz akwaryjnego. Po wykonaniu powyższych czynności, następne części przygotowania eksperymentu różniły się w zależności od badanego kryterium.

W czasie badań nad wpływem temperatury, równolegle z przygotowaniem drożdży do osobnej zlewki o pojemności 1l wlewałem maksymalną ilość wody o temperaturze z przedziału 0-60°C, którą również kontrolowałem z wykorzystaniem termometru laboratoryjnego rtęciowego oraz akwaryjnego. W wodzie znajdującej się w mniejszej zlewce, za każdym razem rozpuszczałem natomiast 10 g białego cukru spożywczego (wyprodukowanego przez Związek Cukrowni Polskich w Toruniu), otrzymując tym samym 4%-owy roztwór stanowiący pożywkę dla badanych organizmów. Za pomocą strzykawki do cewnikowania o pojemności 60 ml, pobierałem 100 ml roztworu, który wstrzykiwałem do kolby stożkowej. Po uprzednim zatkaniu kolby gumowym korkiem, zawartość intensywnie mieszałem aż do uzyskania jednorodnej mieszaniny. Po wymieszaniu, gumowy korek zamieniałem na drugi, przez który przeciągnąłem plastikowy wąż o średnicy 2 mm i długości 30 cm. W ten sposób zabezpieczoną zlewkę wkładałem do akwarium o pojemności 1,5l, którego górną część zabezpieczyłem taśmą izolacyjną, co pozwoliło na utrzymanie kolby w pozycji stojącej po dolaniu wody. Zabezpieczywszy naczynie, do akwarium wlewałem zawartość większej zlewki, którą natychmiast po opróżnieniu całkowicie napełniałem wodą o temperaturze 20°C. Temperaturę wody w zlewce oraz w łaźni wodnej kontrolowałem z wykorzystaniem uprzednio wspomnianych mierników. Aby zabezpieczyć układ przed ogrzaniem bądź ochłodzeniem, korzystałem z kostek lodu lub wrzącej wody, dodawanych po uprzednim wypompowaniu z akwarium za pomocą strzykawki takiej ilości płynu, jaką zamierzałem wprowadzić. Drugi koniec węża przechodzącego przez środek korka umieszczałem w litrowej zlewce wypełnionej wodą. Aby upewnić się, iż wąż będzie za każdym razem napięty w takim samym stopniu, na blacie stołu umieściłem wykonane z taśmy izolacyjnej kontury podstaw obu naczyń, co umożliwiło mi stawianie ich w tym samym miejscu. Co więcej, z tego samego materiału wykonałem oznaczenia, umożliwiające zaczepienie drewnianej łapy laboratoryjnej w tym samym miejscu oraz pozwalające na zanurzenie węża do takiej samej głębokości (fotografia 1.).
Zmiany w metodologii przy badaniu wpływu stężenia substratu oraz odczynu pH dotyczyły pożywki przygotowywanej w mniejszej zlewce. W pierwszym przypadku, regulowana była ilość rozpuszczanego cukru w przedziale 5-35 g (roztwór 2-14%; ponownie wykorzystana została waga laboratoryjna). Badając wpływ odczynu pH, zmianie podlegało natomiast pH pożywki w przedziale od 3 do 9, co kontrolowałem z wykorzystaniem uniwersalnych papierków wskaźnikowych. Aby uzyskać oczekiwaną przeze mnie wartość pH, do roztworu dodawałem 10%-owy roztwór octu spirytusowego (producent: Wytwórnia Octu i Musztardy w Parczewie) lub sody oczyszczonej (produkcja: Gellwe; paczkowana w Zabierzowie). Każdy z eksperymentów trwał łącznie 80 minut. Po 30 minutach od rozpoczęcia doświadczenia, wykonywałem pierwszy, trwający 5 minut pomiar ilości wydzielonych przez S. cerevisiae pęcherzyków CO2, możliwych do zaobserwowania w litrowej zlewce. Po dziesięciu minutach, pięciominutowy pomiar zostawał powtórzony, co w sumie daje nam cztery 5-minutowe pomiary oddzielone 10-minutowymi przerwami.
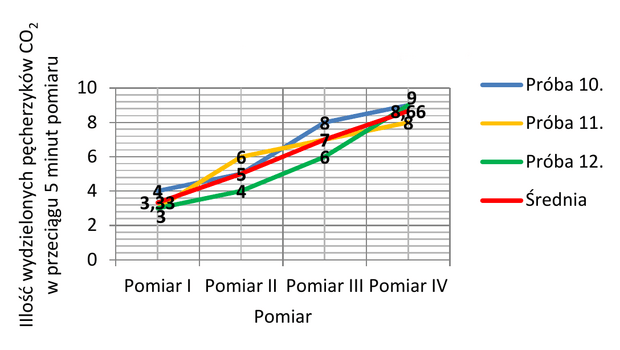
Po zakończeniu eksperymentu, mierzona była także zmiana poziomu roztworu w kolbie oraz zmiana odczynu pH roztworu (niestety, ze względu na ograniczony wymiar mojej pracy, wyniki pomiarów z zakresu dwóch ostatnich kryteriów dostępne są jedynie w przygotowanej przeze mnie dokumentacji laboratoryjnej). Każde doświadczenie powtarzałem trzykrotnie, za każdym razem opracowując wyniki w formie zestawienia umożliwiającego późniejsze obliczenie średniej wartości otrzymanych wyników (wykres 1.), podawanej w ilości pęcherzyków CO2 wydzielonych przez S. cerevisiae w przeciągu 1 minuty pomiaru.
Wyniki
Temperatura otoczenia
Czas trwania badań - 21.06.2014r. - 30.07.2014 r.
Ilość eksperymentów - 40
![Wpływ temperatury otoczenia [℃] na intensywność procesu fermentacji alkoholowej przeprowadzanej przez Saccharomyces cerevisiae](/sites/default/files/styles/large/public/artykuly/obrazy/praca_konrad_wykres_2.png?itok=sEFNo2Pd)
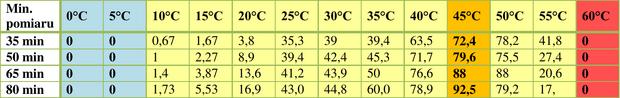
Tabela 2. przedstawia uśrednione wartości wyników pomiarów poszczególnych prób z dokładnością do jednego miejsca po przecinku. Natychmiast można zauważyć, iż fermentacja nie zachodzi zarówno przy temperaturze niższej lub równej 5°C, jak i równej 60°C. W przedziale 10-40°C, intensywność badanego procesu wzrasta, by przy 45°C osiągnąć wartość maksymalną. W owym przedziale temperaturowym widać ponadto, iż intensywność fermentacji alkoholowej wzrasta wraz z upływem czasu. Przy 50°C własność ta ulega zaburzeniu, zaś intensywność zaczyna maleć. W przedostatniej kolumnie (55°C) dostrzegalna jest już wyraźna tendencja spadkowa. Wykres 2. pozwala na łatwiejszą interpretację wyników tabeli. Czerwona strzałka wskazuje optymalną wartość temperatury, zaobserwowaną na podstawie uśrednionej wartości wyników czwartego z pomiarów.
Ilość substratu
Czas trwania badań - 17.07.2014r. - 01.08.2014r.
Ilość eksperymentów - 21
![Wpływ stężenia substratu [%] na instensywność procesu fermentacji alkoholowej przeprowadzanej przez Saccharomyces cerevisiae](/sites/default/files/styles/large/public/artykuly/obrazy/praca_konrad_wykres_3.png?itok=2HyS2EJt)
Wykres 3. obrazuje uśrednione wartości wyników wraz z naniesionym odchyleniem standardowym. Z owych danych jednoznacznie wynika, iż optymalnym stężeniem substratu dla fermentacji alkoholowej przeprowadzanej przez S. cerevisiae jest stężenie równe 6%. Co ciekawe, przy wyższym stężeniu substratu intensywność badanego procesu maleje, co rozmija się z moimi początkowymi założeniami (po całkowitym wysyceniu enzymów, intensywność powinna ustabilizować się na stałym poziomie).
Odczyn pH pożywki
Czas trwania badań - 11.08.2014 r.-17.08.2014 r. Ilość eksperymentów - 13
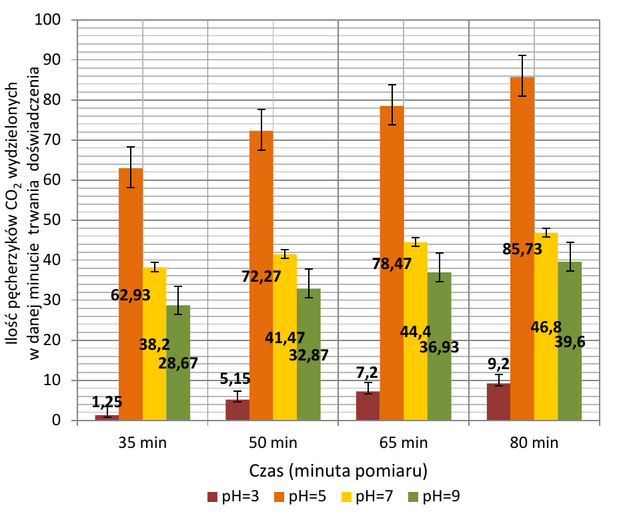
Wykres 4. zawiera uśrednione wartości wyników badań nad wpływem odczynu pH wraz z naniesionym odchyleniem standardowym. Można zaobserwować, iż optymalną wartością pH roztworu dla badanego procesu jest pH zbliżone do 5. Już pH niższe o dwa punkty niezwykle mocno hamuje fermentację (ilość wydzielonych pęcherzyków CO2 jest zbliżona do tej, którą organizmy wydzielają przy temperaturze o 10°C niższej). Odczyn obojętny bądź zasadowy także hamuje fermentację, aczkolwiek w mniejszym stopniu niż pH=3.
Dyskusja
Zamieszczone na poprzednich stronach wyniki wskazują, iż każdy z wybranych przeze mnie czynników w znaczący sposób wpływa na intensywność badanego procesu metabolicznego. Jednym z podstawowych warunków, których spełnienie jest niezbędne do przebiegu fermentacji alkoholowej, jest dostarczenie organizmom określonej porcji energii, w tym przypadku energii cieplnej, pobieranej z otoczenia. W rzeczywistości, wszystkie reakcje chemiczne, zarówno egzo-, jak i endoergiczne, posiadają bowiem energetyczną barierę, zwaną energią aktywacji1, której przekroczenie warunkuje możliwość ich zajścia. Warto zauważyć, iż owa wymagana ilość energii jest znacznie obniżana przez enzymy, dzięki czemu możliwe jest wielokrotne przyspieszenie procesów metabolicznych5. Zahamowanie wydzielania CO2 przez drożdże piekarnicze umieszczone w temperaturze mniejszej lub równej 5°C jest zatem związane z faktem, iż takowa temperatura nie zaspokaja całkowicie zapotrzebowania organizmów na energię termiczną, niezbędną do przeprowadzenia reakcji. Rozpoczynający się przy 10°C wzrost intensywności badanego procesu jest natomiast spowodowany wzrostem energii kinetycznej cząsteczek substratu. 45°C jest dla fermentacji przeprowadzanej przez S. cerevisiae temperaturą optymalną, aczkolwiek jest to jednocześnie temperatura graniczna, której przekroczenie może być dla organizmu fatalne w skutkach. Dalsze podnoszenie temperatury powoduje bowiem stopniową denaturację enzymów oddechowych, co jest widoczne początkowo w zaburzeniu wzrostu intensywności wraz z upływem czasu, a następnie w stopniowym hamowaniu badanego procesu. Występujące pod wpływem zbyt wysokiej temperatury zmiany w strukturze i aktywności enzymów skutkują zaś całkowitą, nieodwracalną utratą zdolności do katalizowania reakcji chemicznych1. Przy 60°C denaturacji ulega całość enzymów, co uniemożliwia zajście fermentacji nawet po schłodzeniu układu. W przypadku nazbyt niskiej temperatury możliwe jest natomiast wznowienie fermentacji po dostarczeniu odpowiedniej ilości energii termicznej (fotografia 2.).
Analizując wpływ drugiego z badanych czynników, już na wstępie warto zauważyć, iż w kontekście omawianych przeze mnie doświadczeń, termin "stężenie substratu" stanowi znaczne uproszczenie - substratem fermentacji alkoholowej jest bowiem glukoza, nie zaś dostarczana w pożywce sacharoza. Aby móc pozyskiwać energię z owego dwucukru, drożdże przeprowadzają reakcję rozkładu sacharozy na glukozę i fruktozę, katalizowaną przez osobny enzym - inwertazę (fruktohydrolazę β-D-fruktofuranozydów)6. Wzrost intensywności badanego procesu towarzyszący wzrostowi stężenia substratu w przedziale 2-6% jest spowodowany faktem, iż większa ilość cząsteczek substratu może wziąć udział w szeregu reakcji chemicznych. Zgodnie z wykresem 5., fermentacja zachodzi najbardziej intensywnie przy 6%-owym stężeniu substratu, gdy enzymy wykazują stan maksymalnego wysycenia.
![Wpływ stężenia substratu [%] na instensywność procesu fermentacji alkoholowej przeprowadzanej przez Saccharomyces cerevisiae](/sites/default/files/styles/large/public/artykuly/obrazy/praca_konrad_wykres_5.png?itok=3NZYMo8C)
Teoretycznie, dalsze zwiększanie stężenia nie powinno powodować zmian w intensywności przebiegu reakcji7. Uzyskane przeze mnie wyniki jednakże wskazują, iż stopniowy wzrost stężenia sacharozy w pożywce zaczyna hamować fermentację, co sprawia, że kształt wykresu w znaczący sposób odbiega od kształtu krzywej Michaelisa, powszechnie wykorzystywanej w opisie wpływu stężenia substratu na szybkość reakcji katalizowanych enzymatycznie. W większości podręczników szkolnych oraz akademickich nie sposób jest się doszukać jakichkolwiek informacji na temat hipotetycznego hamującego wpływu nadmiaru substratu na intensywność procesów metabolicznych w przypadku, gdy nie jest on substancją szkodliwą. Mimo tego, udało mi się dotrzeć do publikacji, wskazujących, iż przyczyną owej anomalii może być wzajemne "przeszkadzanie" sobie cząstek substratu w dostępie do centrów aktywnych enzymów89. Weryfikacja owej tezy wymagałaby jednakże przeprowadzenia znacznej ilości prób dodatkowych, na co niestety nie pozwoliły mi ściśle określone ramy czasowe.
W przypadku pH roztworu, czynnik środowiskowy bezpośrednio wpływa na możliwość tworzenia kompleksu enzym-substrat poprzez regulowanie sił elektrostatycznych łączących obie cząsteczki (układ E-S powstaje łatwiej, zaś reakcja przebiega szybciej)10. Zmiany ładunku oddziałują na wiązania jonowe, odpowiedzialne za trzecio- i czwartorzędową strukturę enzymu katalizującego reakcję, co prowadzi do zmiany konformacji i aktywności białka1. Wyniki jednoznacznie wskazują, iż pH=5 (uzyskane przez dodawanie 2 ml octu do 250 ml pożywki) stwarza najbardziej optymalne warunki do przebiegu fermentacji. Wartość pH roztworu równa 7 (pożywka bez dodatkowych odczynników) lub 9 (uzyskana po dodaniu 5 g sody oczyszczonej do 250 ml roztworu) na badany proces metaboliczny wpływa hamująco, czego dowodem jest spadek ilości wydzielanych pęcherzyków CO2 o ponad połowę. W świetle zawartych powyżej informacji, można zatem przypuszczać, iż wytworzony przez odczyn obojętny lub lekko zasadowy rozkład ładunków elektrycznych wpływa na przestrzenne ułożenie cząsteczek enzymów w taki sposób, że przyłączenie się substratu staje się dużo trudniejsze. Największe zahamowanie badanego procesu przy pH=3 jest natomiast związane z denaturacją enzymów przez nazbyt kwaśne środowisko - tak znaczne zakwaszenie pożywki wymagało wykorzystania aż 14 ml roztworu octu na 250 ml wody.
Powyższe wyniki mogą zostać wykorzystane między innymi w przemyśle piekarniczym, bowiem zapewnienie drożdżom odpowiednich warunków pozwala na efektywne wykorzystanie tych organizmów, skutkujące poprawą jakości produkowanego pieczywa.
Piśmiennictwo
-
Solomon E.P., Berg L. R., Martin D. W. (2005) Biologia - Oficyna Wydawnicza ,,Multico", Warszawa. ↩︎ ↩︎ ↩︎ ↩︎
-
Kączkowski J. (1970) Podstawy biochemii - WNT, Warszawa. ↩︎
-
Hames D., Hooper N. (2012) Krótkie wykłady - biochemia - PWN, Warszawa. ↩︎
-
Szweykowska A., Szweykowski J. (2013) Botanika - tom II - Systematyka - WSiP, Warszawa. ↩︎
-
Berg J.M., Tymoczko J. L., Stryer L. (2011) Biochemia - PWN, Warszawa. ↩︎
-
Sturm A. (1999) Invertases. Primary Structures, Functions, and Roles in Plant Development and Sucrose Partitioning - Plant Physiology, 121: 1-8. ↩︎
-
Zgirski A., Gondko R. (2012) Obliczenia biochemiczne - PWN, Warszawa ↩︎
-
Kąkol P. T. (2007) Biologia - kompendium - Świat Książki, Warszawa. ↩︎
-
Kühl P. W. (1994) Excess-substrate inhibition in enzymology and high-dose inhibition in pharmacology: a reinterpretation - Biochemical Journal, 298: 171-180. ↩︎
-
Filipowicz B., Więckowski W. (1990) Biochemia - tom I - wprowadzenie wiadomości z chemii ogólnej, składniki chemiczne ustrojów, metabolizm - PWN, Warszawa - Łódź. ↩︎
- Zaloguj się albo zarejestruj aby dodać komentarz

