Wpływ stresu termicznego i osmotycznego na Escherichia coli - praca badawcza z Olimpiady Biologicznej

Przedstawiona poniżej praca badawcza została zgłoszona do edycji 2015/2016 Olimpiady Biologicznej i stanowi kontynuację badań przedstawionych w poprzedniej edycji tej olimpiady. Komisja Okręgowa oceniła pracę na 46 pkt co zapewniło jej autorowi uczestnictwo w etapie okręgowym. Zapraszam do lektury!
Zamieszczone na stronie prace służą tylko zapoznaniu się z ogólnym charakterem prac badawczych zgłaszanych na Olimpiadę Biologiczną. Niedopuszczalne jest kopiowanie całej koncepcji wykonania pracy bądź fragmentów jej tekstu we własnej pracy. Tego typu działania będą uznawane za plagiat i mogą wiązać się z odrzuceniem pracy przez komisję olimpiady.
Wpływ szoku osmotycznego na odpowiedź na stres termiczny u Escherichia coli
AUTOR: Maciej Piejko
Streszczenie
Celem niniejszego doświadczenia była weryfikacja możliwego wpływu odpowiedzi stresów hiperosmotycznego i termicznego (niskiej temperatury) na siebie. Warunki hiperosmotyczne indukowano podwyższonym stężeniem NaCl w roztworze. Stwierdzono, że odpowiedź komórek E. coli na stres hiperosmotyczny może skutkować ich zwiększoną przeżywalnością w niskich temperaturach.
Wstęp
Temperatura jest jednym z podstawowych czynników zmiennych w badaniach mikrobiologicznych. Manipulacje nią mogą w zestawieniu z innymi czynnikami wywołać bardzo różnorodne efekty. Ciekawe zjawiska występują w połączeniu ze stresem osmotycznym.
Komórki w odpowiedzi na różne stresy środowiskowe uruchamiają różne mechanizmy biochemiczne umożliwiające dalsze funkcjonowanie w danych warunkach. Dwoma najczęstszymi działającymi stresorami są wysokie ciśnienie osmotyczne i niska temperatura. Mechanizmy odpowiedzi na te stresy przynajmniej częściowo nie są identyczne. Jeśli oba mechanizmy mają element wspólny, to istnieją racjonalne powody do badania ich możliwego wpływu na siebie.
Zaobserwowano, że w warunkach hipoosmotycznych niska temperatura nasila utratę niskocząsteczkowych substancji rozpuszczonych z komórki1. Wykazano także, że prekondycjonowanie komórek w wysokiej temperaturze pozwala im na skuteczniejszą adaptację w warunkach wysokiej siły jonowej2. Oba przypadki różnią się natężeniem stresora oraz typem korelacji odpowiedzi stresowych, która może być zarówno ujemna i utrudniać przetrwanie komórkom oraz dodatnia, kiedy odpowiedź na jeden rodzaj stresu pozwala na skuteczniejszą adaptację do innych warunków stresogennych.
Znając te zależności należy próbować doświadczalnie zbadać, czy zachodzi korelacja także wtedy, gdy temperatura jest niska a warunki - hiperosmotyczne (zapewnione poprzez wysokie stężenie rozpuszczonych, niskocząsteczkowych związków jonowych), i ostatecznie podjąć próbę sformułowania ogólnego wniosku dotyczącego synergizmu stresów osmotycznego i termicznego.
Materiały i metody
| Królestwo | Bakterie |
| Typ | Proteobakterie |
| Klasa | Gammaproteobakterie |
| Rząd | Enterobacteriales |
| Rodzina | Enterobacteriaceae |
| Rodzaj | Escherichia |
| Gatunek | Escherichia coli |
Tab. 1 Systematyka użytego gatunku
Escherichia coli to z pewnością jeden z najlepiej poznanych mikroorganizmów, dzięki któremu zbadano wiele niezwykle istotnych procesów biologicznych jak np. mechanizm replikacji DNA. Jako organizm modelowy jest jednym z najpowszechniejszych obiektów badań. Naturalnie występuje w jelicie grubym człowieka i wielu zwierząt homeotermicznych uczestnicząc w syntezie witamin z grupy B i K. Poszczególne szczepy różnią się od siebie występowaniem różnych czynników zjadliwości ulokowanych często na plazmidach, różnych typów fimbrii mogących umożliwiać patogenną adhezję do komórek gospodarza, zdolności do syntezy toksyn (np. toksyna Shiga)3. Bakteria toleruje zakres temperatur około 15-40°C (jest mezofilem), lecz niektóre szczepy zdolne są do wzrostu nawet w 7,5°C1.
Badane bakterie pochodziły z kolekcji Instytutu Mikrobiologii Uniwersytetu Warszawskiego. Były to mikroorganizmy typu dzikiego. Wszelkie parametry użyte w doświadczeniu zostały dobrane na podstawie literatury naukowej oraz wcześniej przeprowadzonego eksperymentu wstępnego. Doświadczenie przeprowadzono dwukrotnie w laboratorium Instytutu Mikrobiologii UW, do którego uzyskano dostęp za pośrednictwem jego pracowników. Prace prowadzone były w dniach 7-18 września 2015. Rozpoczęły się od zaszczepienia hodowli nocnej w bulionie odżywczym (prod. firmy Biocorp) w kolbie o objętości 150ml. Źródłem komórek był posiew redukcyjny z dnia 01.09.2015r. przechowywany w lodówce laboratoryjnej. Hodowla umieszczona została w inkubatorze z wytrząsaniem w temp. 37°C (V=120RPM). Następnego dnia próbkę hodowli przeniesiono do kolby (objętość 300ml) z bulionem odżywczym i rozcieńczono 20-krotnie, po czym włożono do identycznych warunków wytrząsania na 2h, aby komórki przystosowały się i weszły w fazę wzrostu wykładniczego.
Po ustalonym czasie pobrano próbki przeznaczone do wysiewów i pomiarów gęstości optycznej (OD600 – ang. optical density, λ=600nm) oraz rozdzielono hodowlę na trzy części do trzech identycznych kolb (objętość 150ml). Do dwóch z nich dodano odpowiednio 5ml i 10 ml 3M wodnego roztworu NaCl w celu wywołania warunków stresu osmotycznego. Stężenia NaCl w kolbach wyniosły odpowiednio 0M2 (kontrola), 0,3M i 0,6M4. Aby objętość każdej hodowli była równa (50ml), dodawano odpowiednią objętość wody destylowanej (5 ml i 10 ml)4. Hodowle ponownie przeniesiono do warunków optymalnych temperaturowo (37°C) i inkubowano 1h. Po tym czasie zmieniono warunki temperaturowe i przeniesiono hodowle do innego inkubatora wytrząsającego, gdzie temp. wynosiła 10°C (V=120RPM). W takich warunkach hodowle były wytrząsane przez 2h.
W czasie trwania eksperymentu co 1⁄2h pobierano po 3 próbki każdej hodowli przeznaczone do pomiarów OD600, a co 1h próbki do wysiewów. Pomiary OD600 wykonywano spektrofotometrem Pharmacia Biotech Novaspec II. Wysiewano rozcieńczenie 10-6 - doświadczenie wstępne wykluczyło potrzebę wysiewania innych rozcieńczeń. Każdy wysiew wykonywano w trzech powtórzeniach. Dane z pomiarów absorbancji oraz wysiewów uśredniono (śr. arytmetyczna). Wyliczono poziom istotności statystycznej na podstawie rozkładu t-Studenta i przyjęto granicę istotności α=0,05. Zebrane wyniki zostały przeniesione i opracowane w programie Microsoft Excel 2010.
1. Optymalne warunki wzrostu dla E. coli
2. Stężenie określone na podstawie dodanego roztworu chlorku sodu. W czystej pożywce jego stężenie wynosi 60mmol/l. Sumaryczne ciśnienie osmotyczne buliony odżywczego stanowi rozwtór izotoniczny względem komórek bakteryjnych.
Wyniki
Poziom istotności statystycznej otrzymanych wyników wyniósł 0,05, a więc zgodnie z założeniem wyniki są istotne statystycznie (wynik graniczny z wartością założenia). Analiza wzrostu hodowli odnosi się do wyników posiewów, a wyniki absorbancji rozpatrywane są oddzielnie. W czasie 1h od dodania NaCl wszystkie hodowle wykazywały tendencję wzrostową (wyk.1).
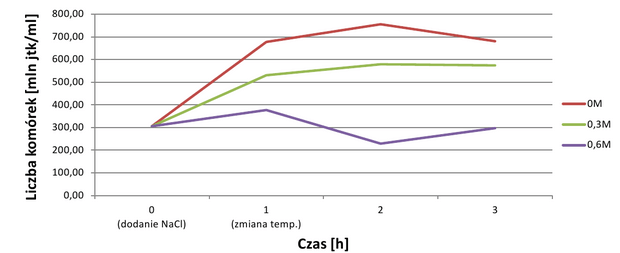
Im wyższe ciśnienie osmotyczne roztworu tym wzrost był powolniejszy, zgodnie z przewidywaniami. Po gwałtownym obniżeniu temperatury inkubacji wzrost liczebności był spowolniony, jeśli stężenie wynosiło 0M lub 0,3M. W hodowli o stężeniu 0,6M komórki zaczęły obumierać, co objawia się spadkiem liczebności powstałych kolonii. Po drugiej godzinie trwania szoku termicznego sytuacja uległa zmianie. Liczebność hodowli kontrolnej, która nie była prekondycjonowana w podwyższonej osmolalności środowiska, zaczęła spadać. W hodowli o stęż. 0,3M wzrost był bardzo powolny, a krzywa wzrostu wypłaszczona.
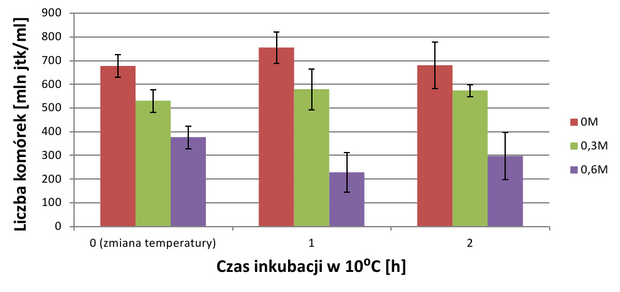
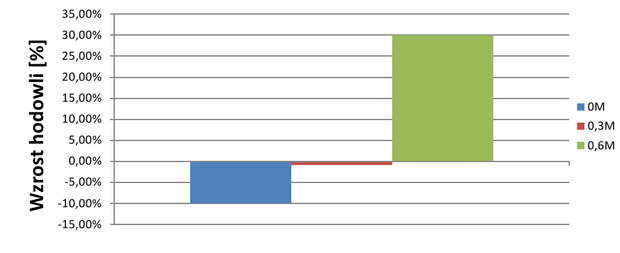
Natomiast ciekawe zjawisko obserwowano w hodowli o stęż. 0,6M – liczebność hodowli zaczęła ponownie wzrastać. Średni procenowy wzrost hodowli wskazuje na duży wzrost hodowli o stęż. 0,6M, podczas, gdy liczebność hodowli o niższych stężeniach NaCl malała (wyk.4).
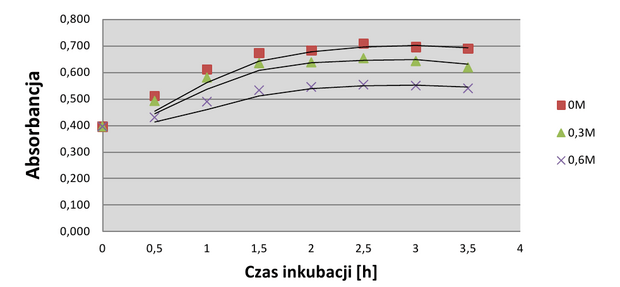
Wykres absorbancji hodowli pokazuje ciągły, nieliniowy wzrost wszystkich hodowli bakteryjnych od początku trwania doświadczenia (wyk.3). Najszybszy wzrost występował w hodowli kontrolnej (0M). Hodowle poddane stresowi osmotycznemu rosły gorzej. Po 1⁄2h inkubacji hodowla kontrolna i hodowla o stęż 0,3M wykazywały niewielką różnicę gęstości, a hodowla o stęż. 0,6M znacznie bardziej odbiegała od dwóch pierwszych. Po zmianie temperatury (x=1h) wzrost każdej hodowli wciąż był widoczny, lecz z czasem wolniejszy. Pod koniec trwania doświadczenia różnica gęstości optycznej hodowli kontrolnej i hodowli o stęż. 0,3M była znacznie większa niż na początku.
Dyskusja
Wyniki pomiarów absorbancji nie są zaskakujące, sugerują jedynie kumulatywny wpływ stresu osmotycznego na liczebność hodowli. Jedynym pewnym wnioskiem jest szkodliwy wpływ zwiększonej osmolarności medium, co nie jest efektem nieoczekiwanym w badaniu. Porównując jednak pomiary OD600 z danymi pochodzącymi z wysiewów, widać pewne odstępstwo od takiego prostego wnioskowania. Pomiary absorbancji pokazują jedynie ogólną liczebność hodowli, przy czym na ich podstawie nie możliwe jest określenie jaka część hodowli to komórki żywe, zdolne do utworzenia kolonii. Absorbancja w czasie trwania eksperymentu nieustannie rosła, pod koniec utrzymywała się na względnie stałym poziomie. Porównując wykresy wzrostu hodowli na podstawie wysiewów oraz wykres absorbancji wnioskować można, że część komórek obumierała, a część dzieliła się, co ogólnie dawało fałszywy wynik obserwowany jako ciągły przyrost gęstości optycznej hodowli.
Opisywany spadek szybkości wzrostu hodowli po zmianie temperatury inkubacji jest prawdopodobnie wynikiem adaptacji do nowych warunków oraz częściowo spowolnieniem procesów metabolicznych w niższych temperaturach. Przy spadku temperatury z 37°C do 10°C i inkubacji w podłożu minimalnym wzrost ustaje na około 4.5h, a czas ten wydłuża się im spadek temperatury jest większy1. Minimalna temperatura wzrostu E. coli determinowana jest przez temperaturę minimalną potrzebną do syntezy białek, a w szczególności w momencie inicjacji translacji1. W temp. 10°C nie ustaje jeszcze biosynteza, ale na pewno uruchamiane są mechanizmy odpowiedzi na stres termiczny, co uzasadnia wybranie takiej wartości do badania (umożliwiło zachodzenie obu procesów).
Zahamowanie biosyntezy obserwuje się również w warunkach hiperosmotycznych, a spowodowane jest to zbyt wysokim stężeniem tzw. niekompatybilnych jonów (niezwiązanch z makroanionami np. kwasami nukleinowymi czy ujemnie naładowanymi białkami), które w przeciwnieństwie do jonów związanych są bardzo aktywne osmotycznie5. Jony mające największe znaczenie dla kontroli ciśnienia osmotycznego cytoplazmy u E. coli to kationy K+ i glutaminian. Zbyt duże stężenie tych jonów powoduje inhibicję niektórych enzymów, co prawdopodobnie przyczynia się do hamowania biosyntezy1. Wykorzystane w badaniu jony Na+ są chemicznie bardzo podobne do kationów K+, a z drugiej strony mechanizmy odpowiedzi stresowej nie są tak wrażliwe na kationy sodowe jak na potasowe, a więc efekty wywołane stresem osmotycznym w przypadku jonów Na+ mogą być łatwiej, wyraźniej obserwowalne, dlatego że komórka wolniej reaguje na zmianę stężenia kationów Na+ niż K+1.
W przypadku synergizmu stresów termicznego i osmotycznego, wysoka temperatura umożliwia adaptację do warunków hiperosmotycznych; komórki Pseudomonas fluorescens wykazują mniejszą śmiertelność w stężeniu NaCl 0,5mol/dm3 i 1mol/dm3, jeśli były poddane wcześniej działaniu temperatury szoku cieplnego przez 3h2. Założono, że takie zjawisko możliwe jest dzięki chociaż częściowemu pokrywaniu się mechanizmów ochronnych na oba stresy środowiskowe. Działanie pierwszego stresora nie pokrywało się czasowo z wpływem drugiego. Jednak na podstawie tak ogólnego wniosku nie można jednoznacznie wskazać punktu wspólnego mechanizmów odpowiedzi stresowych, który zachodzenie takiego zjawiska prawdopodobnie umożliwia.
W tym badaniu po 1h działania stresora – podwyższonej osmolarności środowiska indukowano działanie drugiego – niskiej temperatury zaobserwowano zachodzenie podobnego zjawiska. Na podstawie wykonanego eksperymentu widać, że zwiększone ciśnienie osmotyczne środowiska wywołuje zmiany adaptacyjne, odpowiedź stresową dodatnio skorelowaną odpowiedzią na niską temperaturę. Liczebność hodowli kontrolnej zaczęła spadać po 1h inkubacji w 10°C. Jeśli komórki hodowane są w roztworze o stęż. 0,3M NaCl, to po obniżeniu temperatury wzrost zostaje spowolniony, po 2h liczebność hodowli pozostaje na względnie stałym poziomie (w granicach błędu określonego przez SD3). Jeszcze korzystniejszy efekt prekondycjonowania widać, jeśli stężenie wynosi 0,6M komórki najpierw obumierają, lecz już po pierwszej godzinie inkubacji w niskich temperaturach hodowla znów zaczyna rosnąć. Nie wiadomo jednak jakie jest stężenie graniczne dla takiego zjawiska.
Na podstawie wspólnych wniosków dotyczących synergizmu i danych z literatury wiadomo, że odpowiedzi na stresy termiczny i osmotyczny są skorelowane dodatnio ze sobą (w opisanych przypadkach, dla różnych gatunków bakterii) oraz, że dzieje się to zarówno, gdy stresory są rozdzielone w czasie, jak i gdy nachodzą na siebie.
Chęć jak najdogłębniejszego zbadania mechanizmów odpowiedzi stresowych, poszerzenia wiedzy na temat bakterii Escherichia coli i fakt, że jest to organizm modelowy uzasadnia dalsze, bardziej szczegółowe badania o podobnej tematyce. Być może pozwoli to także na odniesienie tych zależności do innych organizmów używanych w biotechnologii produkcji oraz zoptymalizować ich wykorzystanie.
3. SD – (ang. standard deviancy) odchylenie standardowe
Literatura
-
Ingraham L. John, Marr, G. Allen. Effect of temperature, pressure, pH and osmotic stress on growth W: Escherichia coli and Salmonella cellular and molecular biology, red. F.C. Neidhardt, t. 2, str. 1570-1578, ASM Press Washington DC, 1996. ↩︎ ↩︎ ↩︎ ↩︎ ↩︎ ↩︎
-
Piejko Maciej (2014) Wpływ szoku termicznego na odpowiedź na stres osmotyczny u Pseudomonas fluorescens – wyróżniona praca badawcza z XLIV Olimpiady Biologicznej ↩︎ ↩︎
-
Falkow Stanley. The evolution of pathogenicity in Escherichia, Shigella, and Salmonella W: Escherichia coli and Salmonella cellular and molecular biology, red. F.C. Neidhardt, t. 2, str. 2723-2729 , ASM Press Washington DC, 1996. ↩︎
-
Cheung Chritine, Lee Jenny, Lee Jiyun, Shevchuk Olena (2009) The Effect of Ionic (NaCl) and Non-ionic (Sucrose) Osmotic Stress on the Expression of β-galactosidase in Wild Type E.coli BW25993 and in the Isogenic BW25993ΔlacI Mutant ↩︎ ↩︎
-
Csonka N. Laszlo, Epstein Wolfgang. Osmoregulation. W: Escherichia coli and Salmonella cellular and molecular biology, red. F.C. Neidhardt, t. 1, str. 1210-1223, ASM Press Washington DC, 1996. ↩︎
- Zaloguj się albo zarejestruj aby dodać komentarz
