Wpływ pH, stężenia soli i substratów na fermentację alkoholową u drożdży - praca badawcza z Olimpiady Biologicznej

Kolejna praca badawcza laureata minionej Olimpiady Biologicznej. Praca została wyróżniona na etapie centralnym olimpiady. W załączeniu dostępny jest plakat oraz recenzje, z którymi również polecam się zapoznać. Autorowi natomiast gratuluję sukcesu :)
Zamieszczone na stronie prace służą jedynie zapoznaniu się z ogólnym charakterem prac badawczych zgłaszanych na Olimpiadę Biologiczną. Niedopuszczalne jest kopiowanie całej koncepcji wykonania pracy bądź fragmentów jej tekstu we własnej pracy. Tego typu działania będą uznawane za plagiat i mogą wiązać się z odrzuceniem pracy przez komisję olimpiady.
Wpływ pH, chlorku sodu i stężenia substratów na proces fermentacji alkoholowej drożdży (Saccharomyces cerevisiae).
AUTOR: Wojciech Kopacz
Streszczenie
Celem mojej pracy badawczej było określenie wpływu, jaki na intensywność procesu fermentacji alkoholowej wywierać mogą trzy czynniki biologiczne: stężenie substratu obligatoryjnego dla zachodzenia oddychania beztlenowego, stężenie NaCl oraz pH roztworu. Jako organizm modelowy wykorzystałem drożdże piekarnicze (Saccharomyces cerevisiae) w formie liofilizowanej. Postawiłem tezę, że czynniki biologiczne będą wpływać zarówno na biokatalizatory jak i procesy metaboliczne drożdży. Badałem organizm metodą laboratoryjną w stałej temperaturze 28 stopni Celsjusza, z wykorzystaniem wody z jonizatora. Podczas jednego doświadczenia mierzyłem tylko jedną wartość danej zmiennej. Po przeprowadzeniu wszystkich doświadczeń, przeanalizowaniu wyników i opracowaniu literatury stwierdziłem, że w przypadku drożdży piekarniczych, proces oddychania beztlenowego zachodzi najintensywniej przy 13-to procentowym stężeniu substratu, zerowym stężeniu procentowym NaCl oraz pH pożywki wynoszącego około 7. Graniczne wartości czynników hamują wydajność procesu w znacznym stopniu (niskie jak i wysokie stężenie substratu oraz wysokie stężenie chlorku sodu). lub nawet hamują proces fermentacji w 100% (przy pH równym 3).
Wstęp
Każdy organizm potrzebuje do życia energii uwalnianej ze związków organicznych, które powstały w procesie fotosyntezy lub chemosyntezy. Głównym szlakiem metabolicznym, pozwalającym na uzyskanie energii, jest oddychanie tlenowe lub beztlenowe. Saccharomyces cerevisiae posiadają zdolność do przeprowadzania oddychania beztlenowego - fermentacji alkoholowej, lecz przy obecności tlenu są zdolne do przeprowadzania oddychania tlenowego, którego efektywność energetyczna jest 19 razy wyższa (Aleksander Chmiel, 1994+ ). Drożdże piekarnicze posiadają zestaw enzymów szklaku glikolizy i enzymy niezbędne dla procesu fermentacji alkoholowej. Wytworzony w procesie glikolizy, pirogronian jest przekształcany w etanal oraz jest wydzielany dwutlenek węgla za pomocą enzymu - dekarboksylazy pirogronianowej. W drugim etapie etanal jest redukowany do etanolu, a NADH utleniany do NAD+ przy udziale drugiego enzymu - dehydrogenazy alkoholowej (Biochemia Krótkie wykłady). W czasie każdej próby, zmiana natężenia danego czynnika wywierała wpływ na aktywność procesów metabolicznych badanego organizmu, a w następstwie na efektywność szlaków chemicznych opisanych wyżej. Moim założeniem, było wykazanie jak każdy z czynników wpływa na aktywność biokatalizatorów (Lubert Stryer 2000) i ukazanie jak stres środowiskowy negatywnie wpływa na procesy życiowe (W. Grajek). Poznana wiedza pozwoli na zrozumienie, jak wielki wpływ na funkcjonowanie badanego organizmu może mieć dany czynnik. Saccharomyces cerevisiae są dobrze poznanym organizm lecz nigdzie nie udało mi się znaleźć informacji na temat stężenia, przy jakim proces fermentacji zachodzi najefektywniej. Będąc na wakacjach we Włoszech po raz pierwszy jadłem chleb bez soli. Był on bardziej puszysty i delikatniejszy niż polski chleb wyrabiany z użyciem soli. Ta informacja skłoniła mnie do zbadania wpływu chlorku sodu na proces fermentacji alkoholowej. Drugim powodem zachęcającym do zbadania tego procesu była akwarystyka. Nawożenie dwutlenkiem węgla poprawia wzrost roślin, a domowy sposób z wykorzystanie fermentacji alkoholowej jest świetną alternatywą dla drogich zestawów akwarystycznych przeznaczonych do rozpuszczania dwutlenku węgla. Dobranie odpowiednich wartości badanych czynników pozwoli znacząco skrócić czas „rośnięcia” ciasta, która to informacja będzie przydatna, w czasach kiedy jest moda na zdrowe odżywianie i ludzie coraz częściej decydują się na własnoręcznie wypiekane pieczywo, jak również pozwoli na wyprodukowanie większej ilości dwutlenku węgla w tym samym czasie, czego skutkiem będzie wydajniejsze rozpuszczanie dwutlenku węgla w akwarium i efektywniejszy wzrost roślin akwariowych.
Materiały i metody
Wpływ czynników na proce fermentacji alkoholowej badałem z wykorzystaniem drożdży piekarniczych (Tabela 1.). Podczas każdej z 96 prób przeprowadzonych w dniach 20.11.2016 r. - 02.01.2017 r., wykorzystywałem po 2 g organizmów liofilizowanych (,,Drożdże instant" Dr. Oetkera zakupionych w hurtowni spożywczej „Selgros” w Lublinie. Wybór organizmów pod taką postacią pozwolił na ograniczenie zmianach w żywotności organizmów. Zawartość z 45 opakowań wyspałem do pojemnika, który podczas przechowywania znajdował się w suchym, zacienionym miejscu, w temperaturze pokojowej i był szczelnie zamknięty. Odpowiednią ilość drożdży odważałem na wadze laboratoryjnej (zakupionej w internecie, której dokładność została sprawdzona odważnikami jubilerskimi) z dokładnością do 0.01 g i przenosiłem do zlewki o pojemności 25 ml. Do produkcji wszystkich zacierów była wykorzystywana woda „Nałęczowianka” (skład mineralny dostępny w dokumentacji i na stronie producenta), którą przelewałem do słoika, który szczelnie zamykałem i umieszczałem w akwarium, aby jej temperatura wynosiła 28°C. Wybór wody o znanym składzie mineralnym był nieprzypadkowy. Prowadząc dochodzenie badawcze natchnąłem się na wiele prac, których autorzy udowadniają pływ określonych pierwiastków na proces fermentacji. Dla doświadczeń w których zmienną był stężenie cukru i chlorku sodu, nie zmieniałem wartość pH i wynosiła 7,4. Dla doświadczeń dotyczących wpływu pH na intensywność fermentacji alkoholowej zasadowe pH wody otrzymywałem z użyciem jonizatora wody, a kwasowe pH otrzymywałem poprzez dodawanie 10% octu spirytusowego do zlewki z wodą (wyprodukowanego przez "OCTIM" Wytwórnia Octu i Musztardy Sp. z o.o. w Olsztynku) za pomocą pipety i kontrolowałem pH przy pomocy pH-metru włożonego do zlewki. Zakres pH dla tej próby zmiennej wynosił 3-9. Przygotowanie zacieru różniło się w zależności od badanej zmiennej. Pierwszym badanym czynnikiem było stężenie substratu. Odważałem odpowiednią ilość cukru spożywczego, 1-21 gramów, (cukier kryształ biały wyprodukowany przez „Lidl Polskie sklepy spożywcze sp. z o.o.” w Jankowicach) następnie przesypywałem ją do próbówki. Następnie na wadze ustawiałem zlewkę o pojemności 100 ml, wagę tarowałem i wlewałem wodę za pomocą pipety. Liczbę gramów wody dobierałem tak aby masa wody wraz z cukrem wynosiła 100 gramów. Następnie do zlewki dodawałem 2 g drożdży i mieszałem roztwór do czasu rozpuszczenia się cukru i drożdży. Następnie powstały zacier był przelewany do kolby. Próby badające wpływ pH i stężenia NaCl odbywały z użyciem 13% roztworu sacharozy. Podczas tworzenia zacierów z NaCl, była odważana odpowiednia masa soli, z zakresu 0,025-4 g, (sól kamienna niejodowana „o'Sole” paczkowana przez GENOS, Września), a ilość wody byłą pomniejszana o odważoną ilość soli tak masa aby roztworu utrzymywała się na stałym poziomie 100 gramów. Aparatura badawcza (Fot. 1.) składała się z 2 akwariów. Pierwsze akwarium o pojemności 20 l było wypełnione woda w około 60%. Temperatura wody dla wszystkich doświadczeń wynosiła 28°C i była utrzymywana dzięki grzałce akwarystycznej wyposażonej w termostat o dokładności 0,25°C (Tetra HT 75 o mocy 75 W). Temperaturę mierzyłem za pomocą termometru rtęciowego, termometru akwaryjnego oraz termometru cyfrowego. Aby zapewnić równomierny rozkład temperatury wody w całym akwarium, korzystałem z filtra przepływowego. Kolba o pojemności 0,5 dm3, do której był wprowadzany zacier o masie 100 g (otrzymywanie zacieru zostało opisane powyżej) wraz z 2 gramami drożdży była umieszczana w łaźni wodnej (pierwsze akwarium). Kolba była zamykana gumowym korkiem z otworem przez który przechodził wąż PVC o długości 100 cm i średnicy 0,6 cm. Jego ujście znajdowało się w drugim 40 l akwarium, gdzie był dociążony kamieniem aby zapobiec jego przypadkowemu poruszeniu.

Nad końcem węża, w drugim akwarium, znajdował się cylinder miarowy, obrócony do góry dnem, o pojemności 250 cm3 z naniesioną miarą o dokładności 2 cm3. Ilość gazu, którym był dwutlenek węgla świadczyła o efektywności zachodzenia procesu fermentacji alkoholowej. Pierwszy pomiar wykonywałem po 25 minutach, następne pomiary były wykonywałem co 10 minut, a ostatnim był pomiar po 65 minutach. Zaobserwowane wyniki wprowadzałem do elektronicznego zeszytu laboratoryjnego. Dla wybranych prób, pH zacieru mierzyłem zarówno przed jak i po doświadczeniu, za pomocą elektronicznego pH-metru z dokładnością do 0,1 (zakupionego przez Internet i skalibrowanego dzięki dostarczonym roztworom o znanym pH). Wyniki z tych pomiaru są dostępne w dzienniku. Po zakończeniu każdej próby naczynia laboratoryjne myłem, dokładnie osuszałem, i następnie wykorzystywałem powtórnie. Każda próbę dla danej wartości czynnika powtarzałem odpowiednio 5 razy kiedy badałem wpływ stężenia substratu i 4 razy dla wpływu pH i stężenia NaCl. Następnie zestawiałem ze sobą poszczególne wyniki co umożliwiało mi obliczenie średniej wartości liczby cm3 i odchyleń standardowych, podawanych w liczbie cm3 po określonym upływie czasu.
Wyniki
Stężenie substratu
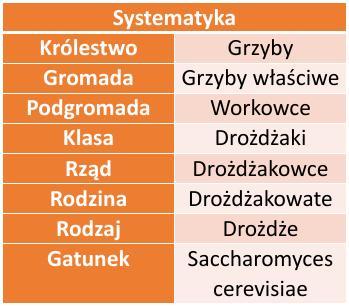
Czas trwania badań: 20.11.2016 r. - 10.12.2016 r. Ilość prób – 55
Tabela 2. zawiera uśrednione wartości wyników pomiarów poszczególnych doświadczeń z dokładnością do jednego miejsca po przecinku. Z przedstawionych danych jednoznacznie wynika, że fermentacja alkoholowa najintensywniej zachodzi przy stężeniu substratu równym 13%. Największy wzrost wydajności można zaobserwować pomiędzy stężeniem 1% a 3% (prawie trzykrotny wzrost liczby dm 3 gazu w 65 minucie). Rzeczą, która mnie zainteresowała, był spadek wydajności reakcji dla wyższych stężeń substratu po osiągnięciu wartości optimum (dla Cp=13%). Największy spadek odnotowałem pomiędzy stężeniem równym 13% a 15%. Dla następnych wartości stężenia cukru, wydajność obnażała się w mniejszym stopniu. Wyniki te, rozbiegały się z moim początkowym założeniem (po wysyceniu wszystkich enzymów, wydajność powinna utrzymywać się na stałym poziomie).
Odczyn pH zacieru
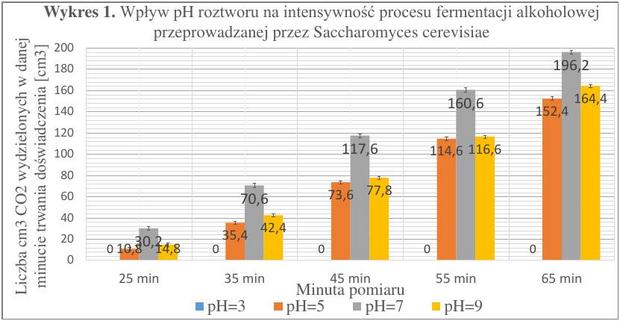
Czas trwania badań - 10.12.2016 r. - 20.12.2016 r. Ilość prób – 20
Wykres 1. zawiera uśrednione wartości wyników badań nad wpływem odczynu pH wraz z naniesionym średnim odchyleniem standardowym, dla danego pH. Z opracowanych wyników wywnioskowałem, że proces fermentacji najintensywniej zachodzi dla pH=7, (przy tej wartości pH i stężeniu cukru wynoszącego 13% otrzymałem najwięcej gazu ze wszystkich prób trzech czynników biologicznych). Najniższe badane pH (o wartości 3) uniemożliwia zachodzenie proces fermentacji alkoholowej. Odczyn zasadowy hamuje badany proces w podobnym stopniu jak odczyn lekko kwasowy (pH=5).
Stężenie NaCl
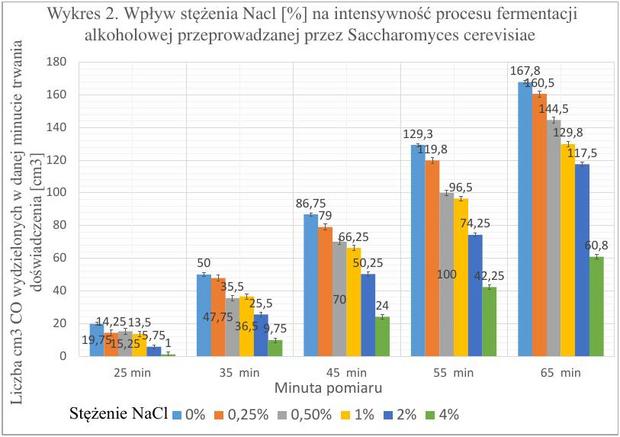
Czas trwania badań - 20.12.2016 r. - 31.12.2016 r. Ilość prób – 20
Wykres 2. zawiera uśrednione wartości wyników badań nad wpływem odczynu pH wraz z naniesionym średnim odchyleniem standardowym, dla danego stężenia chlorku sodu. Przy każdym stężeniu chlorku sodu (oprócz wartości 0%) otrzymywałem mniejszą liczbę cm3 niż dla próby kontrolnej. Na postawie wyników zaobserwowałem, że każde z badanych stężeń wpływa hamująco na proces fermentacji alkoholowej. Najmniejszą wydajność odnotowałem dla stężenia NaCl równego 4%, a największy spadek intensywności badanego procesu pomiędzy wartościami 2% a 4% (dwukrotny wzrost stężenia, skutkował prawie dwukrotnym obniżeniem wydajności).
Dyskusja
Zamieszczone powyżej wyniki wskazują, iż każdy z wybranych przeze mnie czynników w znaczący sposób wpływa na wydajność zachodzenia badanego procesu metabolicznego. Drożdże podczas przeprowadzanego doświadczenie, do oddychania wykorzystują cukier dostarczony w pożywce (sacharozę). Warto zaznaczyć, iż termin „stężenie substratu” stanowi pewne uproszczenie. Substratem reakcji glikolizy (pierwszego etapu fermentacji alkoholowej) nie jest sacharoza, lecz D-glukoza. Drożdże wykorzystują również D-fruktozę, prowadzą jej fosforylację za pomocą heksokinazy i włączają ją do glikolizy (D. Hames).
Aby uzyskać substrat (D-glukozę) i (D-fruktozę) z owego dwucukru, drożdże przeprowadzają reakcję hydrolizy sacharozy na D-glukozę i D-fruktozę. Jest ona katalizowana przez osobny enzym – inwertazę (fruktohydrolazę β-D-fruktofuranozydów) (Aafia Aslam). Wzrostowi stężenia substratu w przedziale 1-13% towarzyszy wzrost wydajności fermentacji alkoholowej. Zależność ta jest spowodowana większą ilością cząsteczek substratu, który może związać się z enzymami, a w następstwie wziąć udział w szeregu reakcji chemicznych. Badany proces zachodzi najintensywniej przy stężeniu równym 13%, gdyż w tych warunkach dochodzi do stanu maksymalnego wysycenia. Zgodnie z krzywą Michaelisa dalsze zwiększanie stężenia nie powinno powodować zmiany wydajności zachodzenia procesu (Bukała, 2007). W wynikach, które opracowałem, zauważyłem, że ze wzrost stężenia sacharozy (powyżej 13%), powoduje spadek intensywności fermentacji alkoholowej. Zaobserwowana zależność jest niezgodna z krzywą Michaelisa, powszechnie używanej w opisach wpływu stężenia substratu na szybkość reakcji katalizowanych enzymatycznie. W podręcznikach szkolnych nie znalazłem wiadomości na temat na temat hamującego wpływu nadmiaru substratu na intensywność procesów metabolicznych. Przeszukując strony Internetowe natrafiłem na publikacje, w której jest opisana inhibicja substratowa, jednym enzymów, który ulega inhibicji podanego rodzaju jest dehydrogenaza alkoholowa (Michael C. Reed, 2010). Zakłada ona że enzym posiada dwa miejsca w których może przyłączyć się cząsteczka substrat (centrum aktywne i centrum allosteryczne. Podczas małego stężenia substratu dochodzi do połączenia cząsteczki tylko z jednym miejscem i utworzenia kompleksu E-S i powstaniu E+P (wolny enzym i produkt) po reakcji. Podczas zwiększania stężenia substratu w roztworze pojawia się więcej cząsteczek, które mogą połączyć się z miejscem allosterycznym. Powstaje enzym S-E-S. Przyłączenie 2 cząsteczki substratu powoduje spadek szybkości reakcji, a po zajściu reakcji zostaje uwolniony E+P+S (wolny enzym, zdolny do wiązania kolejnych cząsteczek substratu, produkt i cząsteczka substratu). W następstwie dochodzi do zmniejszenia wydajności działania dehydrogenazy alkoholowej czego skutkiem jest gromadzenia się aldehydu octowego w komórce, który to jest dla niej szkodliwy (K. Kumański).
Każdy enzym ma optymalną wartość pH przy której działa najefektywniej. Proces fermentacji alkoholowej jest szlakiem metabolicznym, w którym bierze udział wiele enzymów o różnej wartości pH. Wywnioskowałem, że badany proces zachodzi najintensywniej przy pH równym 7. Małe odchylenia wartości pH (pH=5 i 9) od wartości optymalnej wywołują zmiany jonizacji grup w miejscach aktywnych enzymów (D. Hames). Utrudnia to przyłączenie cząsteczek substratu. Wyjaśnia to, dlaczego zaobserwowałem spadek wydajności reakcji dla tych wartości. Większe odchylenia od optimum prowadzą do zakłóceń słabych oddziaływań niekowalencyjnych, utrzymujących przestrzenną strukturę białka (D. Hames), a więc do jego denaturacji co ma miejsce dla wartości pH równej 3. Dla tej wartości stężenia jonów wodorowych proces fermentacji nie zachodzi. Przed rozpoczęciem procesu pH roztworu wynosiło 3, po zakończeniu doświadczenia zmierzone pH wyniosło około 3,5. Wskazywało to na przenikanie jonów wodorowych z roztworu, do komórek drożdży. Szkodliwe działanie kwasu octowego wynika nie tylko ze wzrostu stężenia jonów wodorowych wokół komórki, ale także wskutek wnikania tych kwasów do wnętrza komórki i ich wewnątrzkomórkowej dysocjacji (Włodzimierz Grajek). Uwalniane na tej drodze jony wodorowe muszą być szybko usunięte z wnętrza komórki przez pompy protonowe, co wymaga dużych nakładów energii. Przy stężeniu kwasu octowego na poziomie 80 mM może nawet dojść do zaprogramowanej śmierci komórek (Włodzimierz Grajek). Podczas badania wpływu NaCl na proces fermentacji pominąłem stężenie i chlorkowych, kationów sodu anionów ponieważ ich stężenie w użytej wodzie jest znikome. Wraz ze wzrostem stężenia NaCl rośnie ciśnienie osmotyczne roztworu. Powoduje to odpływanie wody z drożdży, czego skutkiem jest wystąpienie stresu osmotyczny. Reakcja drożdży na wzrost ciśnienia zewnątrz komórkowego, jest synteza glicerolu i jego częściowa akumulacja, czego skutkiem jest wzrost ciśnienia osmotycznego i zapobieganie dalszemu odpływowi wody. (Włodzimierz Grajek, 2008). Wraz z geometrycznym wzrostem stężenia NaCl zaobserwowałem spadek wydajności procesu fermentacji. Drożdże, aby zapobiec lizie są zmuszone do wykorzystywania energii na produkcję substancji. Czynnik biologiczny w całym badanym zakresie wpływa negatywnie i jego usunięcie lub ograniczenie wpłynie na wzrost intensywności procesu fermentacji.
Przeprowadzenie opisanej pracy badawczej umożliwiło zrozumienie procesu fermentacji alkoholowej. Jego wyniki posłużą mi do produkcji zacierów o lepszej wydajności, co pozwoli na dostarczanie większej ilości CO2 do akwariów. Statystyczny Polak zjada około 52 kg chleba rocznie (dane z GUS-u, 2012 r.). Średnia zawartość soli w chlebie wynosi 1,6 g/100 g (dziecisawazne.pl). Brak używania soli do wypieków chleba, pozwoli na ograniczenie jej spożywania o 8,64 kg w skali rocznej. Będzie to mieć zbawienny wpływ na zdrowie (Jerzy Głuszek), jak również podniesie walory smakowe pieczywa.
Piśmiennictwo
- Aleksander Chmiel Biotechnologia postawy mikrobiologiczne i biochemiczne, Wydawnictwo Naukowe PWN, Warszawa 1994
- J. Mowszowicz Zarys systematyki roślin, Państwowe Wydawnictwo Naukowe, Warszawa 1974
- Barbara Bukała Komórka metabolizm komórkowy, Wydawnictwo Szkolne Omega, Kraków 2007
- Michael C. Reed, Anna Lieb, H. Frederik Nijhout The biological significance of substrate inhibition: A mechanism with diverse functions
- Krzysztof Kumański, Agnieszka Kamińska Obiektywne spojrzenie na zły aldehyd octowy
- Włodzimierz Grajek, Daria Szymanowska-Powałoska, Stresy środowiskowe działające na drożdże Saccharomyces cerevisiae w procesie fermentacji etanolowej
- D.Hames, N.Hooper, Biochemia Krótkie wykłady, Warszawa 2012
- http://dziecisawazne.pl/8-produktow-o-wysokim-poziomie-soli/ (dostęp: 08.01.2017 r. )
- Jerzy Głuszek, Wpływ soli kuchennej w diecie na ciśnienie tętnicze i stan zdrowia
- Aafia aslam, Jkram-ul-haq, Sikander ali, Purification and characterization of two invertases from mutant strain of saccharomyces cerevisiae
- Szweykowska A., Szweykowski J. Botanika tom II Systematyka, WSiP, Warszawa. 2013
- Lubert Stryer Biochemia, Wydawnictwo Naukowe PWN, Warszawa 2000
- Zaloguj się albo zarejestruj aby dodać komentarz
